O que são óxidos básicos?
Este artigo busca explicar em detalhes a classificação de óxidos com base na natureza e propriedade dos compostos. Os óxidos são compostos binários formados pela reação do oxigênio com outros elementos. O oxigênio é altamente reativo na natureza. Eles reagem com metais e não-metais para formar óxidos de diferentes tipos, sendo um deles os óxidos básicos.
O que são óxidos?
Um óxido é um composto binário que obtemos na reação do oxigênio com outros elementos. Dependendo do teor de oxigênio, podemos organizá-los em óxidos mistos e simples. Um óxido de um metaloide geralmente tem uma tendência a ser ácido. Por outro lado, um óxido de metal mostra uma tendência básica. Os óxidos dos elementos dentro ou perto da faixa de canto dos semimetais são geralmente anfotéricos. Vamos agora olhar para os diferentes tipos de óxidos.
Leia também
A classificação dos óxidos é feita em neutro, anfotérico e básico ou ácido, com base em suas características ácido-base.
Um óxido ácido é um óxido que, quando combinado com a água, libera um ácido.
Um óxido básico é um óxido que, quando combinado com a água, libera uma base.
Quando uma substância reage quimicamente, tanto como base quanto como ácido, ela é denominada solução anfotérica.
Óxido neutro é aquele que não tem uma característica ácida ou básica.
Os óxidos metálicos tem um número de oxidação de -2 e geralmente compreendem um ânion de oxigênio. A crosta terrestre é composta principalmente por óxidos sólidos. Os revestimentos de óxido também podem ser formados sobre elementos puros, por exemplo, uma folha de alumínio é coberta por uma fina camada de Al2O3, e esta camada defende o resto da folha contra a corrosão.
Classificação dos óxidos
Dependendo da natureza e das propriedades exibidas pelos compostos, elas são classificadas em
Óxidos ácidos
Óxidos básicos
Óxidos anfotéricos
Óxidos neutros
Abaixo, destacaremos os aspectos e características principais dos óxidos básicos.

Entenda a construção dos óxidos básicos e sua função na química moderna. (Foto: Yeshiva University)
Óxido básico
Os metais reagem com o oxigênio para fornecer compostos básicos de oxigênio. Estes compostos são geralmente de natureza iônica. O grupo 1, 2 e os lantanídeos formam compostos básicos de oxigênio quando reagem com o dioxigênio. Durante a formação desses compostos, uma grande quantidade de energia é liberada. Estes compostos reagem prontamente com a água, exceto algumas exceções.
Exemplos: M2O3, MO2, ThO2
Na2O + H2O → 2NaOH
Um óxido básico reage com a água para dar uma base. Exemplos incluem o óxido da maioria dos metais, como Na2O, CaO, BaO. Estes são básicos por natureza.
O óxido de cálcio reage com a água e produz hidróxido de cálcio, uma base.
CaO + H2O → Ca (OH) 2
Propriedades químicas dos óxidos básicos
Considere as propriedades químicas dos exemplos de óxidos básicos em reações químicas.
1. Reação com água
Na reação com a água, e a forma da base ou álcali:
CaO + H2O → Ca (OH) 2 (reação conhecida como calagem, libera uma grande quantidade de calor)
2. Reação com ácidos
O reagir com ácido e a forma de sal e água (uma solução de sal em água):
CaO + H2SO4 → CaSO4 + H2O (cristais desta substância CaSO4 são conhecidos em todos os lugares como “gesso de Paris”)
3. Reação com óxidos ácidos
Na reação com óxidos ácidos, formam-se os sais:
CaO + CO2 → CaCO3 (esta substância é conhecida como giz)
Ficou alguma dúvida sobre os óxidos básicos? Deixem nos comentários suas perguntas e iremos responder!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também

Qual a classificação das soluções?

O que é metano? Como se forma?

Corrosão, o que é? Exemplos e tipos!
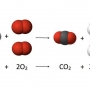
O que é equação química?