Modelos atômicos, quais os tipos?
Cada modelo sucessivo de átomos e construção atômica foi baseado no modelo anterior. Filósofos, teóricos, físicos e cientistas desenvolveram progressivamente o paradigma atômico ao longo de muitos séculos. Vários modelos hipotéticos foram propostos, modificados e eventualmente rejeitados ou aceitos. Muitos cientistas e pensadores fizeram descobertas e conduziram experimentos para chegar ao modelo atômico atualmente aceito. O desenvolvimento da matemática e tecnologia especializada contribuiu grandemente para a compreensão contemporânea da natureza dos átomos.
Leia também
O modelo atômico esférico inicial ou bola de bilhar
Como os átomos são pequenos demais para serem vistos, os primeiros modelos teóricos foram construções intelectuais baseadas nos métodos lógicos de raciocínio indutivo e dedutivo. O filósofo grego clássico Demócrito foi o primeiro a propor a existência de átomos em 400 a.C. Ele argumentou que a matéria não pode ser dividida indefinidamente e deve consistir em partículas redondas indivisíveis chamadas átomos. Em 1800, John Dalton chegou à mesma visão do atomismo usando o método experimental para estudar gases e compostos. Sua teoria foi chamada de esfera sólida, ou modelo de bola de bilhar.
Modelo de pudim de ameixa
Em 1904, o físico britânico J.J. Thompson postulou o pudim de ameixa, ou pão de passas, modelo de atomismo. Foi baseado no conhecimento das partículas subatômicas negativamente carregadas recentemente descobertas, chamadas elétrons. Os experimentos de Thompson com tubos de raios catódicos levaram-no a teorizar a existência de minúsculas partículas dentro de átomos que eram partes fundamentais de todos os átomos. Seu modelo previa os elétrons negativos, ou ameixas, suspensos dentro de uma estrutura de carga positiva, ou o pudim.
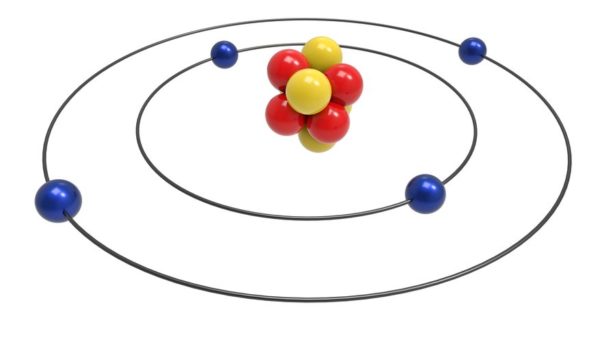
Os modelos atômicos foram se incrementando e cada um deles trouxe inovações na visão de como os átomos funcionam. (Foto: Sciencing)
O modelo nuclear
Em 1906, Ernest Rutherford e seus assistentes realizaram o famoso experimento da folha de ouro que levou às descobertas do núcleo atômico e que o átomo é na maior parte do espaço. Esta experiência determinou que a massa de um átomo era a mesma que J.J. Modelo de Thomson. O volume da massa era muito menor e parecia estar localizado no centro do átomo. Assim, em 1911, o modelo de Thompson não funcionou, e Ernest Rutherford propôs o modelo nuclear do átomo.
Dois modelos de órbita planetária
De 1910 a 1911, Ernest Rutherford propôs o modelo planetário ou nuclear do átomo. Ele acreditava que os átomos eram compostos principalmente de espaço vazio, com um núcleo denso. Seus experimentos envolveram a gravação de partículas alfa em folha de ouro. Ele concluiu que o núcleo positivo contém a maior parte da massa do átomo. Com seu modelo de órbita, Niels Bohr refinou a ideia do átomo como um minúsculo sistema solar em 1913. O modelo de Bohr tinha elétrons orbitando o núcleo em camadas semelhantes a conchas.
O modelo de Bohr. em 1913, Neils Bohr sugeriu colocar a teoria quântica no modelo de Rutherford. O novo modelo de Nelis Bohr sugeriu que os elétrons estão em níveis fixos de energia que ele chamou de órbitas. A energia dessas órbitas é múltipla e os elétrons absorvem ou liberam energia (que são prótons) em certos comprimentos de onda para se moverem entre os níveis de energia.
A evolução dos modelos atômicos para o modelo de nuvem eletrônica
Louis de Broglie e Erwin Schrodinger desenvolveram o modelo de nuvem de elétrons ou mecânica quântica. Eles basearam o modelo nos avanços do ramo da mecânica quântica da física. Em vez de elétrons em órbitas fixas, o modelo de nuvem tem as órbitas definidas por uma distribuição de probabilidade ao redor do núcleo. Dependendo de sua observação e medição, os elétrons podem estar em muitos lugares diferentes, às vezes simultaneamente.
Em 1921, Louis de Broglie disse, sem qualquer evidência de que se as ondas têm propriedades de matéria com matéria, deveriam ter propriedades de onda. Laboratórios da Bell provariam que a hipótese de De Broglies estava correta. A hipótese de De Broglies foi uma revelação que impressionou Einstein e mudou a visão do átomo para sempre. Erwin Schrodinger sugeriu que o elétron era uma forma de onda 3D que circulava o núcleo em um número inteiro de comprimentos de onda permitindo que a onda se repetisse com uma onda estacionária estável que representasse os níveis de energia do modelo de Bohr.
Schrodinger desenvolveu uma equação matemática para descrever o comportamento das ondas. do elétron. A equação de onda não apenas forneceu os níveis de energia corretos para os átomos de hidrogênio, mas também foi útil em átomos com mais de um elétron. Esta equação matemática descreveu os detalhes do comportamento atômico ficou conhecido como o modelo mecânico de onda.
Ficou alguma dúvida sobre os modelos atômicos? Deixem nos comentários suas perguntas para que possamos ajudar!
Sobre o autor
André é formado em pedagogia, já tendo dado aulas na educação infantil e atuado como professor e coordenador de cursos de inglês. Entendendo como funciona o processo de aprendizagem, decidiu escrever para o blog Múltipla Escolha onde postagens sobre aprendizado, provas, concursos, e muito mais para ajudar seus leitores a aprenderem.
Veja também
O que é número atômico?

O que é e para que serve a energia cinética?
O que é equação química?

O que são funções inorgânicas?